Eisen-Kohlenstoff-Gemisch
Ein Eisen-Kohlenstoff-Gemisch wird als binäres System bezeichnet. Das Verhältnis dieses Systems hat große Auswirkungen auf die Werkstoffeigenschaften von Gusseisen und Stahl und das Verhalten bei Hitzezufuhr. Dieses Verhältnis wird im Eisen-Kohlenstoff-Diagramm dargestellt. Allerdings ist das EKD nicht mehr aussagekräftig, wenn die Abkühlung zu schnell geht. Dann eignet sich ein Zeit–Temperatur Umwandlungsschaubild (ZTU) besser.
Darstellung der Phasen
Das Eisen-Kohlenstoff-Diagramm stellt die verschiedenen Phasen von Eisen-Kohlenstofflegierungen in Abhängigkeit von der Temperatur und dem individuellen Kohlenstoffgehalt dar. Dabei zeigt die x-Achse die Massenprozente des Kohlenstoffs an und die y-Achse zeigt die Temperatur. Es wird nur der technisch interessante Kohlenstoffgehalt von 0 bis 6,67 % betrachtet. Bei 6,67 % liegt der Kohlenstoff zu 100 % als Zementit vor.
Zudem gibt es im Eisen-Kohlenstoff-Diagramm verschiedene Linien und Punkte zur Abgrenzung der Phasen. Die Linien veranschaulichen die verschobenen Haltepunkte je nach Temperatur. Die wichtigsten Punkte sind durch Buchstaben gekennzeichnet. Die folgende Tabelle führt die wichtigsten Punkte im metastabilen System auf.
| Punkt | Kohlenstoffgehalt in % | Temperatur in °C |
|---|---|---|
| A | 0 | 1.536 |
| B | 0,53 | 1.493 |
| C | 4,3 | 1.147 |
| D | 6,67 | 1.320 |
| E | 2,06 | 1.147 |
| F | 6,67 | 1.147 |
| G | 0 | 911 |
| H | 0,1 | 1.493 |
| I/J | 0,16 | 1.493 |
| K | 6,67 | 723 |
| N | 0 | 1.392 |
| P | 0,022 | 723 |
| S | 0,8 | 723 |
| Q | 0,002 | 20 |
| M | 0 | 769 |
| S‘ | 0,69 | 738 |
| E‘ | 2,03 | 1.153 |
| C‘ | 4,25 | 1.153 |
Liquiduslinie
Die Liquiduslinie verbindet die Punkte A, B, C und D. Oberhalb dieser Linie liegt eine komplette Schmelze vor. Die Legierung ist flüssig. Unterhalb der Linie beginnt bei sinkender Temperatur die Primärkristallisation und erste Mischkristalle bilden sich, bis die Soliduslinie folgt.
Soliduslinie
Zwischen der Liquidus– und der Soliduslinie liegt eine breiige Konsistenz vor. Unter der Soliduslinie ist die Legierung komplett erstarrt. Die Linie verbindet die Punkte A, H, I/J, E, C und F. Die genauen Parameter und Phasen sind abhängig vom Kohlenstoffgehalt. Es lagern sich beispielsweise α -und δ-Mischkristalle ein. Die Löslichkeit von Kohlenstoff unterscheidet sich je nach Gitterstruktur der Mischkristalle.
Eutektikale
Die Eutektikale verläuft entlang der Punkte E, F und C. Hier entsteht das Eutektikum. Über dieser Linie existieren feste und flüssige Phasen nebeneinander, zum Beispiel γ-Mischkristalle und Zementit. Unterhalb der Eutektikale bildet sich Ledeburit. Dieses eutektische Kristallgemisch besteht aus γ-Mischkristallen und Zementit.
Eutektoide
Die Eutektoide verläuft konstant bei 723° C und verbindet die Punkte P, S und K. Unterhalb dieser Linie liegt Perlit vor, ein eutektoides Kristallgemisch.
Sättigungslinie
Die Sättigungslinie (auch Löslichkeitslinie) verbindet die Punkte S und E. Sie veranschaulicht die maximale Löslichkeit von Kohlenstoff in Eisen. Bei einem Kohlenstoffgehalt von 0,8 % bis 2,06 % ist die Löslichkeit begrenzt und ein Teil des Kohlenstoffs wird als Sekundärzementit ausgeschieden.
Peritektikale
Die Peritektikale verläuft zwischen den Punkten H, I/J und B. Das Peritektikum ist der Punkt, an dem α-Mischkristalle, γ-Mischkristalle und Zementit koexistieren.
Sonstige Linien im Phasendiagramm
Die GPQ-Linie befindet sich links im Eisen-Kohlenstoff-Diagramm und umgrenzt einen Temperaturbereich mit ausschließlich α-Mischkristallen. Hier ist nur ein Kohlenstoffgehalt von unter 0,02 % löslich. Die DL-Linie befindet sich am rechten Rand. Hier liegt 100% Zementit vor. Der Massegehalt steigt also von links nach rechts.
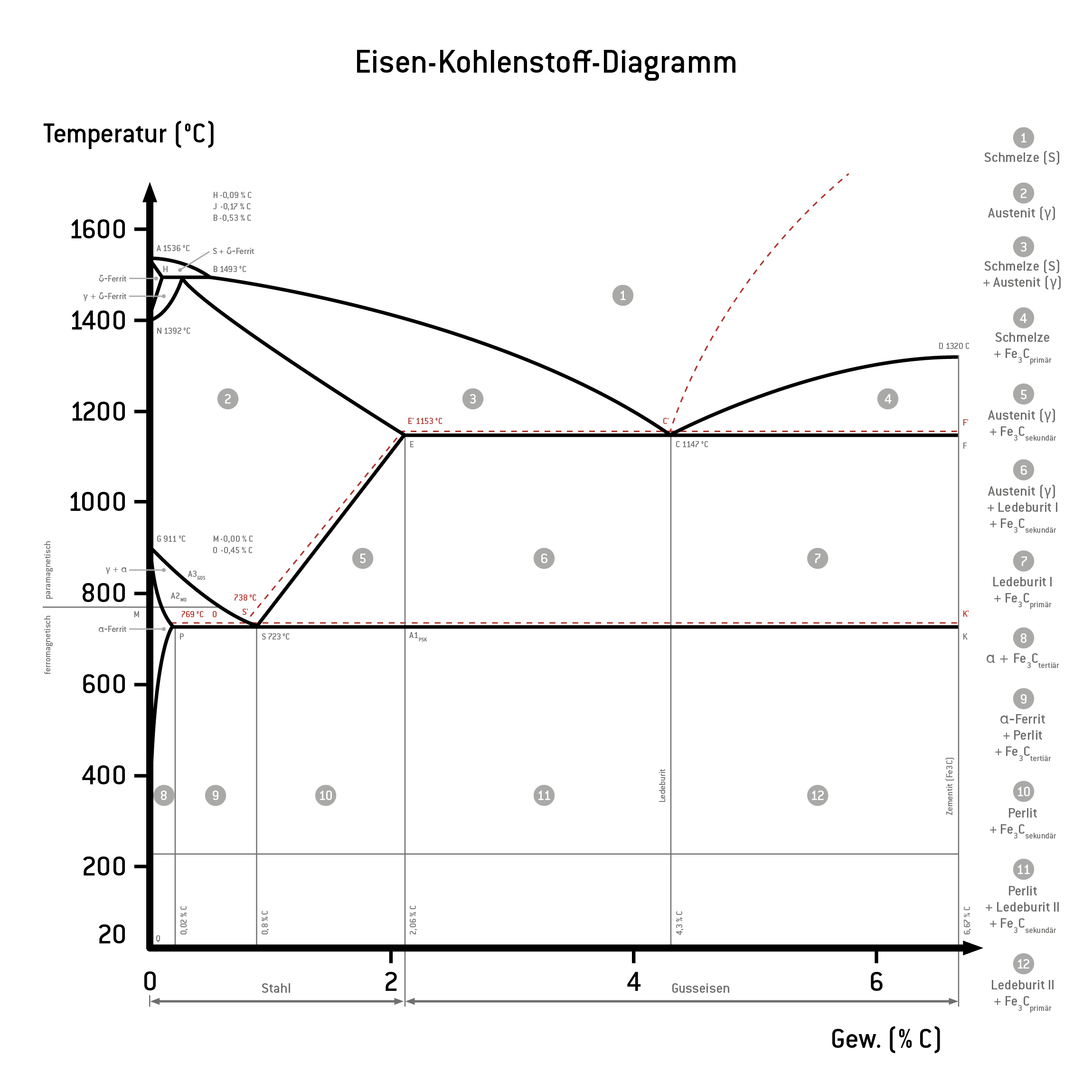
Eisen-Kohlenstoff-Diagramm (schwarz: metastabil, rot:stabil) mit Gefügebeschreibung
Unterteilung des Eisen-Kohlenstoff-Diagrammes
Das Eisen–Kohlenstoff–Diagramm wird in fünf Phasen unterteilt:
- Phase 1: Die Schmelze beschreibt eine flüssige Eisen-Kohlenstoff-Legierung oberhalb der Liquiduslinie. Zwischen der Liquiduslinie und der Soliduslinie liegt ein Gemisch aus Schmelze und Mischkristallen vor.
- Phase 2: Diese Phase ist durch δ-Ferrit und seine kubisch raumzentrierte Kristallstruktur gekennzeichnet.
- Phase 3: Hier liegt Austenit in γ-Mischkristallen vor, eine kubisch flächenzentrierte Kristallstruktur. Das Material ist nun weich, zäh und gut umformbar.
- Phase 4: In dieser Phase liegt α-Ferrit vor, dessen kubisch raumzentrierte Kristallstruktur spröder ist als die von Austenit.
- Phase 5: Im stabilen System liegt nun Graphit vor, im metastabilen System Zementit, das sehr hart und spröde ist.
Zudem können bei langsamer Abkühlung im stabilen oder metastabilen System die Phasengemische Perlit und Ledeburit entstehen. Auch diese sind hart und spröde. Bei schnellerer Abkühlung verwandelt sich Austenit in Martensit. Je nach Legierung und Abschreckparametern kann Restaustenit im Material verbleiben.
Isotherme Reaktionen und Linien im Eisen-Kohlenstoff-Diagramm
Das Eisen–Kohlenstoff–Diagramm stellt drei isotherme Reaktionen als horizontale Linien dar:
- HIB-Linie: peritektische Reaktion
- EFC-Linie: eutektische Reaktion
- PSK-Linie: eutektoide Reaktion
Zudem zeigt das EKD wichtige Haltepunkte für die Umwandlung der Phasen:
- Punkt A1 liegt bei 723 °C auf der PSK-Linie. Bei einem Kohlenstoffgehalt von mehr als 0,02% zerfällt Austenit zu Perlit.
- Punkt A2 ist auch als Curiepunkt bekannt. Der Punkt liegt auf der MO-Linie bei 769 °C. Hier verliert Ferrit seinen Ferromagnetismus..
- Punkt A3 liegt bei 723 °C auf der Linie GOS-Linie. Unterschreitet die Legierung bei der Abkühlung diese Linie bildet sich kohlenstoffarmer Ferrit. Austenit reichert den freigewordenen Kohlenstoff an und erreicht eine eutektoide Konzentration.
Metallografische Bezeichnung
Die Metallografie unterscheidet die intermetallischen Phasen des Zementits nach Primärzementit, Sekundärzementit und Tertiärzementit. Primärzementit entsteht bei der Primärkristallisation der Schmelze an der CD-Linie. Sekundärzementit bildet sich bei der ES-Linie als Ausscheidung des Austenits. Tertiärzementit wird von Ferrit an der PQ-Linie ausgeschieden.
Metallografische Bezeichnung der Mischkristalle:
| Phasengemische | Zusammensetzung | Kohlenstoffgehalt | Temperatur |
|---|---|---|---|
| Perlit | 88 % Ferrit und 12% Zementit | 0,02 % bis 6,67 % | Geringer als 723°C |
| Ledeburit I | 51,4 % Austenit und 48,6 % Zementit | 0,02 % bis 6,67 % | Ab 723 °C bis 1.147°C |
| Ledeburit II | 51,4 % Perlit und 48,6 % Zementit | 2,06 % bis 6,67 % | Geringer als 723°C |
Metallografische Bezeichnung der Phasengemische:
| Phasengemische | Zusammensetzung | Kohlenstoffgehalt | Temperatur |
|---|---|---|---|
| Perlit | 88 % Ferrit und 12% Zementit | 0,02 % bis 6,67 % | Geringer als 723°C |
| Ledeburit I | 51,4 % Austenit und 48,6 % Zementit | 0,02 % bis 6,67 % | Ab 723 °C bis 1.147°C |
| Ledeburit II | 51,4 % Perlit und 48,6 % Zementit | 2,06 % bis 6,67 % | Geringer als 723°C |
Anwendung
Das Eisen-Kohlenstoff-Diagramms hilft, das Verhalten von Stahl und Gusseisen zu verstehen. Zum Beispiel lassen sich die Schmelztemperaturen von reinem Eisen sowie die Temperaturen der beginnenden Aufschmelzung von Stahl und Gusseisen gemäß des jeweiligen Kohlenstoffgehalts ablesen.
Es wird schnell ersichtlich, dass sich Stahl gut zum Schmieden eignet, weil er laut Diagramm innerhalb seines breiten und homogenen Austenitbereichs gut verformbar ist. Bei Gusseisen erschweren die Bildung von Graphit und Ledeburit hingegen die Verformung. Dafür ist Gusseisen einfacher gießbar als Stahl, weil der Schmelzpunkt niedriger liegt.
Die visuelle Darstellung dieser Merkmale im Eisen-Kohlenstoff-Diagramm hilft bei der Analyse und dem Verständnis der Eigenschaften und Verhaltensweisen vielfältiger Eisenlegierungen.
